Le silicium est un élément chimique de la famille des cristallogènes, de symbole Si et de numéro atomique 14. C'est l'élément le plus abondant dans la croûte terrestre après l'oxygène, soit 25,7 % de sa masse, mais il n'est comparativement présent qu'en relativement faible quantité dans la matière constituant le vivant. Il est en revanche bien présent dans les produits cosmétiques.
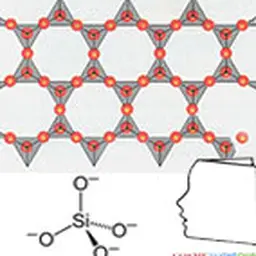
Il n'existe pas dans la nature à l'état de corps pur, mais sous forme de composés : dioxyde de silicium (SiO₂), silice (dans le sable, le quartz, la cristobalite, etc.) ou autres silicates (dans les feldspaths, la kaolinite…).
Son nom dérive du latin
silex, silicis
qui signifie caillou ou silex.
Les cristaux de silicium sont gris à noirs, en forme d'aiguille ou d'hexaèdres (forme cubique). La phase amorphe est une poudre marron foncé.
Le silicium est un semi-conducteur, sa conductivité électrique est très inférieure à celle des métaux. Il est insoluble dans l'eau (sauf à haute température). Le silicium présente des reflets métalliques bleutés, mais n'est pas du tout aussi ductile que les métaux. Il existe trois isotopes naturels du silicium : ²⁸Si (92,18 %), ²⁹Si (4,71 %) et ³⁰Si (3,12 %). Il existe également des isotopes artificiels instables : ²⁵Si, ²⁶Si et ²⁷Si qui sont émetteurs β⁺, ainsi que ³¹Si à ³⁴Si qui sont émetteurs β⁻.
Un des composés du silicium, la silice (dioxyde de silicium ou SiO₂), était déjà connue dans l'Antiquité. La silice a été considérée comme élément par les alchimistes puis les chimistes.
Antoine-Laurent Lavoisier avait soupçonné son existence en 1787, mais la chimie du silicium a démarré lorsque le silicium a été isolé pour la première fois en 1823 par Jöns Jacob Berzelius. Ce n'est qu'en 1854 que Henri Sainte-Claire Deville obtient du silicium cristallin.
Outre les propriétés du silicium élémentaire, de nombreux composés du silicium possèdent des applications. Parmi les plus connus :
• la
silice
se trouve dans la nature sous forme compacte (galets, quartz filonien par exemple), ou de sable plus ou moins fin. On l'obtient aussi industriellement, sous forme pulvérulente (silice synthétique). Elle a de nombreux usages :
> le
verre
est fabriqué depuis des millénaires en faisant fondre du sable principalement composé de SiO₂ avec du carbonate de calcium CaCO₃ et du carbonate de sodium Na₂CO₃. Le verre peut être amélioré par différents additifs,
> le sable de silice est un des composants des céramiques,
> le
quartz
forme de superbes cristaux. Il est utilisé comme matériau transparent, plus résistant à la chaleur que le verre (ampoule de lampes halogènes). Il est également beaucoup plus difficile à fondre et à travailler,
> la silice intervient aux côtés du noir de carbone dans la fabrication des pneumatiques économes en énergie (pneus "verts"),
> la silice très fine est utilisée comme adjuvant pour les bétons à haute performance ;
• le ferro-silicium et le silico-calcium sont utilisés comme éléments d'addition dans l'élaboration d'aciers ou de fontes ;
• le
carbure de silicium
possède une structure cristalline analogue à celle du diamant ; sa dureté en est très proche. Il est utilisé comme abrasif ou sous forme céramique dans les outils d'usinage ;
• le silicate de calcium CaSiO
3
est un des composants des ciments.
• Des
recherches récentes
permettent d'envisager de nouvelles utilisations de silicium.
Le silicium n'existe pas naturellement à l'état libre sur la terre, mais il est très abondant sous forme d'oxydes, par exemple la silice ou les silicates. Le silicium est extrait de son oxyde par des procédés métallurgiques, et son niveau de pureté dépend de son utilisation finale. Ces différentes considérations ont conduit à ce que le silicium ne soit utilisé que dans certains types d’application. Il est utilisé depuis très longtemps sous forme d'oxyde de silicium amorphe (silice ou SiO₂) comme composant essentiel du verre. Il a depuis le milieu XXe siècle de nouveaux usages en électronique (transistor), pour la production de matériaux tels que les silicones ou pour fabriquer des panneaux solaires photovoltaïques.
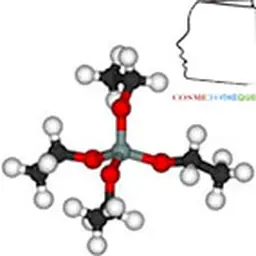
Il faut signaler, pour éviter une fréquente erreur de traduction depuis l'anglais, que l'anglais silicon signifie silicium, tandis que silicone correspond bien au silicone. De son côté, silica désigne la silice.
Dans les produits cosmétiques
, le Silicium est utilisé indirectement sous différentes formes et dans différents types d’applications. Ce sont principalement :
• les silicates minéraux naturels et synthétiques,
• Les colloïdes,
• la silice,
• les silicones,
• le silicium organique,
• les SolGel.
Nous allons aborder ces différentes utilisations dans une série de contributions à venir.
◊♦◊♦◊♦◊♦◊♦◊♦◊♦◊♦
Controverse
Pourquoi alors le carbone l'emporta-t-il sur Terre ?
Il a été évoqué la possibilité d'une tout autre forme de vie basée principalement sur le silicium et non pas le carbone. Ceci pourrait se fonder sur le fait que le silicium est non seulement tétravalent comme le carbone, mais qu'il est susceptible de former des complexes penta- et hexa-coordinés chargés et stables. Toutefois, il faut remarquer l'extrême difficulté du silicium à former des liaisons multiples qui sont nécessaires au fonctionnement des échanges dans la cellule. Les exemples de molécule de silicium présentant des liaisons multiples ou des valences différentes de IV sont possibles uniquement avec des substituants particulièrement complexes. Aux basses températures, la structure du silicium est très stable et se prête facilement au stockage de l’information. Mais par -220°C les réactions chimiques sont fortement ralenties. À des températures plus raisonnables, les propriétés chimiques du silicium ne permettent pas une structure moléculaire aussi variée que celle du carbone et le stockage de l'information s'affaiblit. Par ailleurs, échangeant difficilement ses électrons, le silicium n'est pas utilisé dans les échanges entre cellules. Il refuse souvent de s'associer avec les autres atomes. Le silicium n'est pas non plus soluble dans l'eau. Enfin, il se trouve dans l'univers en quantité dix fois plus faible que le carbone. Son abondance chute à 7 % dans le système solaire.
Certaines théories
envisagent que le silicium pourrait présenter une autre forme de vie. En effet, les exobiologistes ont spéculé sur l'existence de formes de vie bâties non plus sur du carbone, mais sur un atome aux propriétés analogues, le silicium. Mais, cette hypothèse est pour le moment peu validée. C'est ainsi que pour une centaine de molécules carbonées, on trouve seulement quelques molécules silicatées. L'Univers ne semble donc pas s'être beaucoup amusé avec le silicium. Pour l'instant, seule la science-fiction donne vie à des organismes dont la biologie diffère radicalement de celle des êtres terrestres
.
Pour en savoir plus
•
http://fr.wikipedia.org/wiki/Silicium
•
http://www.astrosurf.com/luxorion/bioastro-chimiesi.htm
•
http://sili.cium.free.fr/ch3.htm
•
http://www.universalis.fr/encyclopedie/silicium/
•
http://www.espace-sciences.org/sciences-ouest/comprendre-le-sable-sa-chimie-ses-applications
 Contribution réalisée par Jean Claude Le Joliff
Contribution réalisée par Jean Claude Le Joliff
Biologiste de formation, Jean Claude Le Joliff a été un homme de R&D pendant de nombreuses années. Successivement en charge de la R&D, puis de la Recherche et de l’Innovation dans un grand groupe français de cosmétiques et du luxe, et après une expérience de création d’un centre de recherche (CERIES), il s’est tourné vers la gestion de l’innovation. Il a été par ailleurs Professeur associé à l’Université de Versailles Saint Quentin (UVSQ) et reste chargé de cours dans le cadre de plusieurs enseignements spécialisés : ISIPCA, IPIL, ITECH, UBS, UCO, SFC etc. Il est le fondateur de inn2c, société de conseil en R&D et Innovation. Consultant auprès de plusieurs sociétés internationales, il a participé activement à des projets comme Filorga, Aïny, Fareva, et bien d’autres. Il a créé la Cosmétothèque®, premier conservatoire des métiers et des savoirs faire de cette industrie. |